MÓDULO 2
Tema 3. Trastorno por déficit de atención e hiperactividad
M.ªI. Hidalgo Vicario, C. Soutullo Esperón
Resumen
El trastorno por déficit de atención e hiperactividad (TDAH) es un trastorno generalmente crónico del neurodesarrollo, muy heterogéneo, altamente heredable y que afecta al 5-8% de los niños en edad escolar. Su etiopatogenia es multifactorial, con interrelación de factores neurobiológicos, genéticos y ambientales. El órgano afectado es el cerebro, que presenta alteraciones del volumen en la sustancia gris (espesor cortical y ganglios basales), de los circuitos cerebrales y de la conectividad funcional interregional. La clínica varía según la edad, el sexo, el contexto y el temperamento del paciente, así como con la presencia o no de comorbilidad. Debido a todo esto, el TDAH tiene un gran impacto en todas las áreas del funcionamiento del individuo y en su calidad de vida. Hasta en el 50% de los casos se mantiene en la edad adulta, causando una comorbilidad psiquiátrica significativa, como abuso de sustancias, depresión, ansiedad, disfunción social y familiar, con riesgo de muerte si se deja sin tratar o no se trata a tiempo. Es necesario realizar un diagnóstico precoz que es exclusivamente clínico.
Introducción
El trastorno por déficit de atención e hiperactividad (TDAH) es un trastorno del neurodesarrollo caracterizado por un patrón concreto de comportamiento y de funcionamiento cognitivo; se inicia en la infancia y puede evolucionar en el tiempo, y es susceptible de provocar graves dificultades en el funcionamiento cognitivo, educacional/laboral y social del individuo, tanto en el presente como en el futuro.
El pediatra de atención primaria es la puerta de entrada del individuo al sistema sanitario, a quien atiende desde el nacimiento y es responsable de su salud integral. Por ello, este profesional debe contar con unos conocimientos básicos sobre TDAH necesarios para atender debidamente a los pacientes con este trastorno; así lo recomienda la Academia Americana de Pediatría en sus guías de práctica clínica de 2000, 2005 y 2011, con un nivel de evidencia B y un fuerte grado de recomendación: «el pediatra debe adquirir la formación específica en el TDAH y, una vez adquirida, debe atender al niño integralmente». En este capítulo se van a abordar los aspectos más importantes del TDAH: su etiopatogenia, sus manifestaciones clínicas, su diagnóstico y su tratamiento, así como su pronóstico.
Desarrollo histórico del concepto de TDAH
La historia del TDAH se remonta a 1798, con una primera descripción de Alexander Crichton. Más tarde, en 1865, en el cuento infantil titulado Felipe el enredador, Hoffman convierte en protagonista a un niño con síntomas de hiperactividad, impulsividad y desobediencia que causa muchos disgustos a sus padres.
En 1902, en un artículo publicado en The Lancet, el pediatra inglés George Still describió a una serie de niños con síntomas de lo que él denominó «déficit del control moral», por su impulsividad y negativismo. En España, el maestro de primaria Vidal Parera, en su Compendio de psiquiatría infantil (1907), dedicó un capítulo a los «Estados morbosos de la atención por defecto», sobre niños con una atención como la de las mariposas, o niños atolondrados; la clínica descrita es muy similar a la recogida en la quinta edición del Manual diagnóstico y estadístico de los trastornos mentales (DSM-5). Unos años más tarde, en 1917, en el libro Los niños mentalmente anormales, el neurólogo y psiquiatra Rodríguez-Lafora hablaba de niños con síntomas de TDAH, y lo atribuía a un «problema cerebral, de probable origen genético».
En 1932, Kramer y Pollnow acuñaron el término «trastorno hipercinético de la infancia», cuyos síntomas aparecían a edades tempranas (a los 3-4 años, con un pico a los 6). Entre 1930 y 1960, el trastorno pasó a llamarse «daño cerebral mínimo» y luego «disfunción cerebral mínima», porque se suponía que había una lesión o disfunción demasiado pequeña como para ser detectada. Paralelamente, desde 1950 se hablaba de «trastorno hipercinético impulsivo», que más tarde pasó a denominarse «síndrome hipercinético». Ya en la década de 1960 se describe el síndrome del niño hiperactivo.
En 1968, el DSM-II hablaba de «reacción hipercinética de la infancia»; en 1980, en el DSM-III, pasó a llamarse «trastorno por déficit de atención con/sin hiperactividad», y en 1987, en la revisión DSM-III-R, se adoptó el nombre actual: «trastorno por déficit de atención e hiperactividad». En el DSM-III-R se distinguían 3 subtipos, el inatento, el hiperactivo-impulsivo y el combinado, que sobrevivieron en el DSM-IV (1994) y en el DSM-IV-TR (2000), pero que desaparecieron en el DSM-5 (2013). En Europa se ha aceptado el planteamiento del DSM-5, y el trastorno hipercinético se entiende como una forma más grave de TDAH.
El estudio MTA (Tratamiento Multimodal del TDAH) demostró que el tratamiento médico supera los resultados del tratamiento psicosocial para los síntomas centrales de TDAH.
Epidemiología
Hay muchos estudios sobre la prevalencia del TDAH en diferentes países, desde hace más de 20 años. Los resultados pueden parecer dispares, debido a las diferencias metodológicas. Los estudios que utilizan cuestionarios de padres o de profesores obtienen cifras más altas que los que emplean cuestionarios de padres y de profesores (los dos alternados). Los más exactos son los que, además de los cuestionarios para padres y profesores, incluyen una entrevista a los padres para confirmar el diagnóstico. Otra fuente de variabilidad depende de la edad de los pacientes, o de si se usan muestras clínicas de atención primaria, especializada, o muestras epidemiológicas no clínicas, que mostrarían la verdadera prevalencia del TDAH en la población general.
En 2 metaanálisis recientes de Polanczyk et al. (2007 y 2015), que incluían numerosos estudios epidemiológicos, se observaron unas cifras de prevalencia de alrededor del 5-7%, algo más altas en niños que en adolescentes y más elevadas en varones que en mujeres (4/1 y 2/1). La disparidad entre los resultados es mayor en los estudios efectuados en África y Latinoamérica, y menor en Europa y Norteamérica. Al comparar los datos que ofrecen los distintos trabajos a lo largo del tiempo, se observa que la prevalencia se ha mantenido estable en las últimas décadas. No es cierto que la prevalencia epidemiológica del TDAH haya aumentado, como muchas veces sostiene la prensa no científica sesgada contra el TDAH. Lo que sí ha aumentado es la «prevalencia administrativa», es decir, el número de casos diagnosticados, debido a que ahora se diagnostican antes los casos, tanto en edades más tempranas como en fases menos graves de la enfermedad.
Definición
El DSM-5 (Asociación Americana de Psiquiatría, 2013) define el TDAH como un trastorno del neurodesarrollo, subrayando su carácter evolutivo y separándolo de los trastornos del comportamiento y de la conducta disruptiva en los que estaba englobado antes (DSM-IV, 1994 y DSM-IV-TR, 2000), junto con el trastorno negativista desafiante y el trastorno de conducta disocial. El TDAH se define como la presencia, desproporcionadamente elevada para lo esperable según el nivel de desarrollo, de síntomas de hiperactividad, impulsividad e inatención, que causan problemas en, al menos, dos entornos vitales de la vida del niño, presentes desde antes de los 12 años de edad y que no se deben a problemas médicos, abuso de sustancias u otros trastornos psiquiátricos.
Hasta el DSM-IV-TR, se definían 3 subtipos de TDAH: el predominantemente inatento (30% de los cuadros, más frecuente en las mujeres), el predominantemente hiperactivo-impulsivo (10-15% de los casos, cuestionado por algunos autores) y el combinado (60-70% de los cuadros). Esta división por subtipos se eliminó porque no eran estables en el tiempo, y los pacientes cambiaban varias veces de subtipo de TDAH a lo largo de los años; en la actualidad (DSM-5) no se habla de subtipo, sino de presentación actual.
Criterios del DSM (tabla 1)
La versión actual del DSM es la quinta, disponible desde 2013 (antes en números romanos, y desde el DSM-5 en números arábigos). Esta versión tiene algunos cambios de variable profundidad respecto a la definición anterior (DSM-IV-TR, 2000). Los cambios más sustanciales han sido los siguientes:
- La edad de inicio, anterior a la cual se requiere que haya síntomas que causen deterioro, pasa de los 7 a los 12 años. Esto no supone un aumento de la prevalencia, pero sí una mejora en la detección del TDAH en edades más tardías (adolescencia y edad adulta), pues estos pacientes pueden no recordar síntomas de antes de los 7 años, pero sí de antes de los 12 años. Además, este cambio supone una ventaja a la hora de diagnosticar mejor a pacientes con síntomas inatentos, que puede que no hayan tenido grandes problemas escolares, al no molestar en clase, hasta cursos superiores de Educación Primaria o de Educación Secundaria, que es cuando se detectan.
- Se ha cambiado el umbral diagnóstico y ahora se requieren, al menos, 6 síntomas de inatención o de hiperactividad-impulsividad para niños de entre 0 y 16 años (igual que en el DSM-IV-TR), pero sólo 5 síntomas para adolescentes de 17 años y adultos. Este cambio se debe a que con la edad se van perdiendo síntomas, y si se seguían exigiendo 6 síntomas, muchos adultos no alcanzaban el umbral diagnóstico, pero presentaban deterioro e impacto funcional.
- Se han suprimido los subtipos como tales, porque no eran estables en el tiempo; sin embargo, se siguen reconociendo las diferentes presentaciones, y ahora lo que antes eran «subtipos» pasan a llamarse «presentación actual inatenta, hiperactiva-impulsiva o combinada».
- En los criterios de exclusión se elimina el trastorno del espectro autista (en el DSM-IV llamado trastorno generalizado del desarrollo que incluye el autismo), permitiendo el diagnóstico conjunto de TEA y TDAH, que no se podía hacer en el DSM-IV-TR.
- Otros cambios menores incluyen la descripción de cada síntoma más adecuada al nivel de desarrollo, poniendo ejemplos no sólo de comportamientos de niños sino también de adolescentes y adultos.
Durante el desarrollo del DSM-5 se consideró reducir a 4 el umbral de síntomas requeridos para el diagnóstico en adultos, pero finalmente se optó por reducirlo sólo a 5, para no aumentar el diagnóstico en adultos. También se consideró incluir el subtipo inatento-restrictivo (niños exclusivamente con TDAH inatento sin ningún síntoma de hiperactividad-impulsividad), denominado por otros autores «tempo cognitivo lento», pero finalmente, en parte por falta de datos empíricos, se dejó de lado esta idea.
También se especifica que los pacientes pueden padecer TDAH en grado leve, moderado o severo (según el número de síntomas que experimenta la persona y cuán dificultosa hacen dichos síntomas la vida cotidiana). Asimismo, se reconoce la existencia de trastorno «en remisión», que permitirá la retirada terapéutica.
La Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud, en su décima revisión (CIE-10), de la Organización Mundial de la Salud aún no se ha actualizado, y se espera la CIE-11 para 2018. En la CIE-10 se define el TDAH de modo más estricto, y se llama «trastorno hipercinético», de manera que este trastorno sería una forma más grave de TDAH. Éste exige la presencia de los 3 tipos de síntomas, no reconociendo en principio la presencia del subtipo inatento del DSM-IV-TR.
Etiopatogenia
El TDAH es un trastorno de etiología multifactorial, en el que influyen factores neurobiológicos y múltiples genes junto con factores ambientales. Dentro de las causas ambientales, se han identificado las complicaciones pre/perinatales, como el peso bajo al nacer, la prematuridad y la exposición al tabaco o el alcohol del embrión y el feto durante el embarazo. Otros factores, como la adversidad psicosocial, los diferentes estilos educativos, la interacción familiar o la presencia de psicopatología de los padres, están implicados como variables moduladoras de la evolución del TDAH. Se estima que el 65-75% de las causas del TDAH se deben a la herencia genética, y el 25-35% restante son atribuibles a factores adquiridos.
Bases neurobiológicas
El órgano afectado en el TDAH es el cerebro, que presenta alteraciones en el volumen y el espesor cortical, hipo/hiperfunción de algunas áreas y circuitos, y alteraciones en la conectividad funcional interregional. Las disfunciones neuropsicológicas están producidas por una disregulación de la neurotransmisión, debido a una alteración genética de las proteínas receptoras y transportadoras de dopamina (DA) y noradrenalina (NA) en estas áreas y circuitos cerebrales. Los circuitos cerebrales alterados son los siguientes:
- Función ejecutiva clásica, o «fría» (atención selectiva, mantenida y dividida; control de interferencias; inhibición motora; integración en espacio y tiempo; planificación; anticipación de consecuencias y memoria de trabajo), localizada en el córtex prefrontal dorsolateral (DLPFC) y las redes frontocerebelosas y frontoparietales.
- Función ejecutiva «caliente», que regula la motivación, la recompensa y la regulación del humor, y la capacidad de tomar decisiones en función de la recompensa y del tiempo de espera (aversión a la espera), localizada en los circuitos mesolímbico-ventromediales, orbitofrontal-estriatal y límbicos.
Modelos neuropsicológicos y neuroanatomía funcional básica en el TDAH
Evolución del modelo de Russell Barkley de función ejecutiva
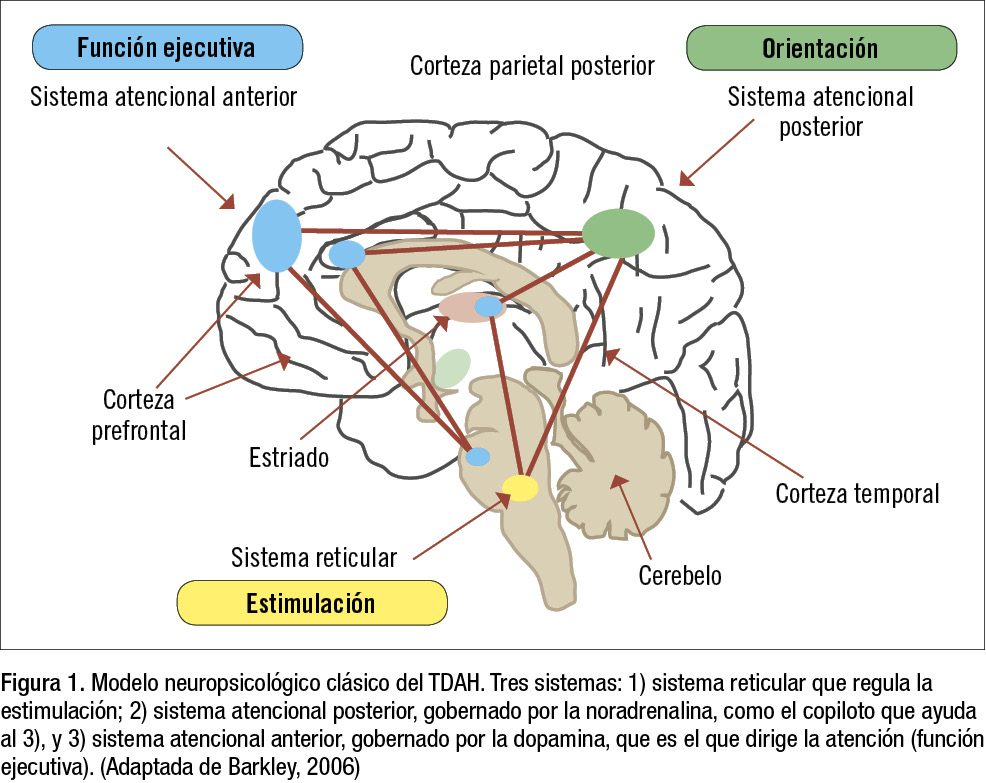
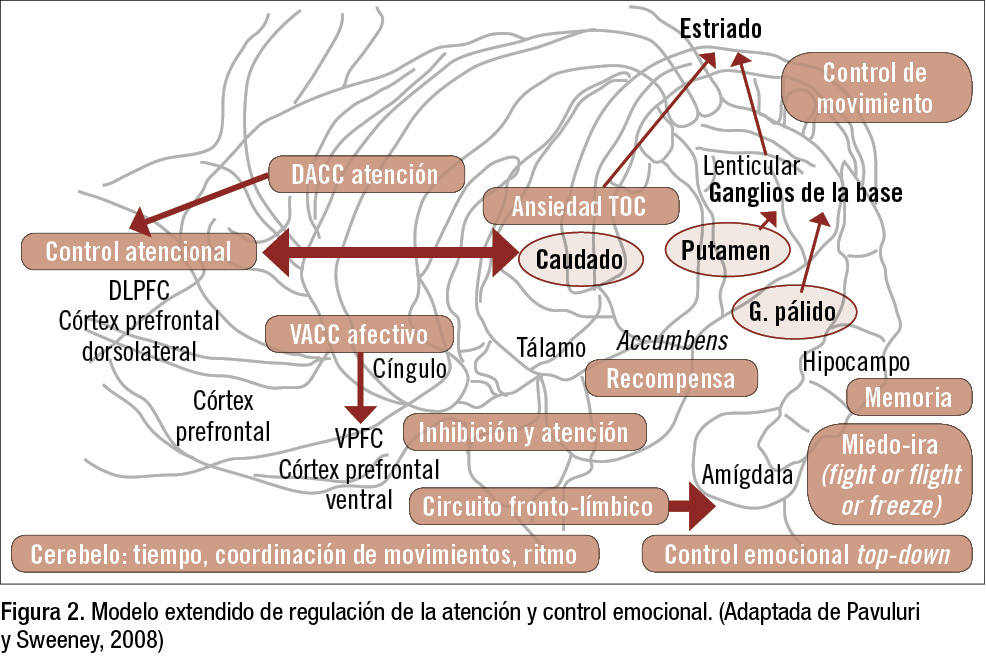
El modelo clásico del TDAH desarrollado por Barkley (2006) (figura 1) localiza la función ejecutiva en la corteza prefrontal (principalmente el DLPFC), con conexiones hacia el cíngulo anterior, también implicado en la atención y la regulación del humor, el estriado (formado por los ganglios de la base, globus pallidus y putamen, que juntos forman el núcleo lenticular, y el núcleo caudado) implicado en el control del movimiento (estriado), con especial implicación en la planificación de los movimientos por el globus pallidus, y en la percepción y el control de la ansiedad (caudado) (figura 2).
En el nucleus accumbens reside el sistema de recompensa del cerebro; ante cualquier estímulo placentero, como la comida, el sexo y sustancias de abuso, se produce una elevación de dopamina en el mismo (figura 2). Esta red conforma el sistema atencional anterior, cuyas funciones son: focalizarse en el estímulo importante para la tarea que se está realizando (inhibiendo pensamientos y atención a estímulos distractores), atención dividida en 2 tareas simultáneas, y atención mantenida hasta terminar la tarea (figura 1). Esta parte anterior está gobernada principalmente por la DA.
Además, es necesario el sistema atencional posterior, localizado en la corteza parietal posterior. Éste monitoriza acciones no rutinarias y estímulos entrantes (decidiendo si son importantes para la tarea que se está realizando o para otra tarea posterior, y lo anota mental o físicamente, o si se trata de un estímulo distractor), y además presta atención al espacio (hemisferio derecho) y al tiempo (hemisferio izquierdo). Este sistema, gobernado principalmente por la NA, conecta hacia delante con el sistema atencional anterior por conexiones frontotemporales, y es importante una conexión fluida. Esta conexión anteroposterior se desarrolla con la edad, y es mínima en los niños, intermedia en los adolescentes y completa en los adultos (también es menor en los varones que en las mujeres a cualquier edad).
Finalmente, para que todo el sistema funcione, es necesaria una activación basal, que parte del sistema reticular activador ascendente y manda radiaciones DA desde el área del tegmento ventral en la protuberancia hacia zonas frontales y al cíngulo anterior y otras áreas (figura 1). Si el sistema reticular activador no está funcionando, la persona estaría durmiendo o en coma. Su funcionamiento correcto es condición necesaria pero no suficiente para una correcta atención.
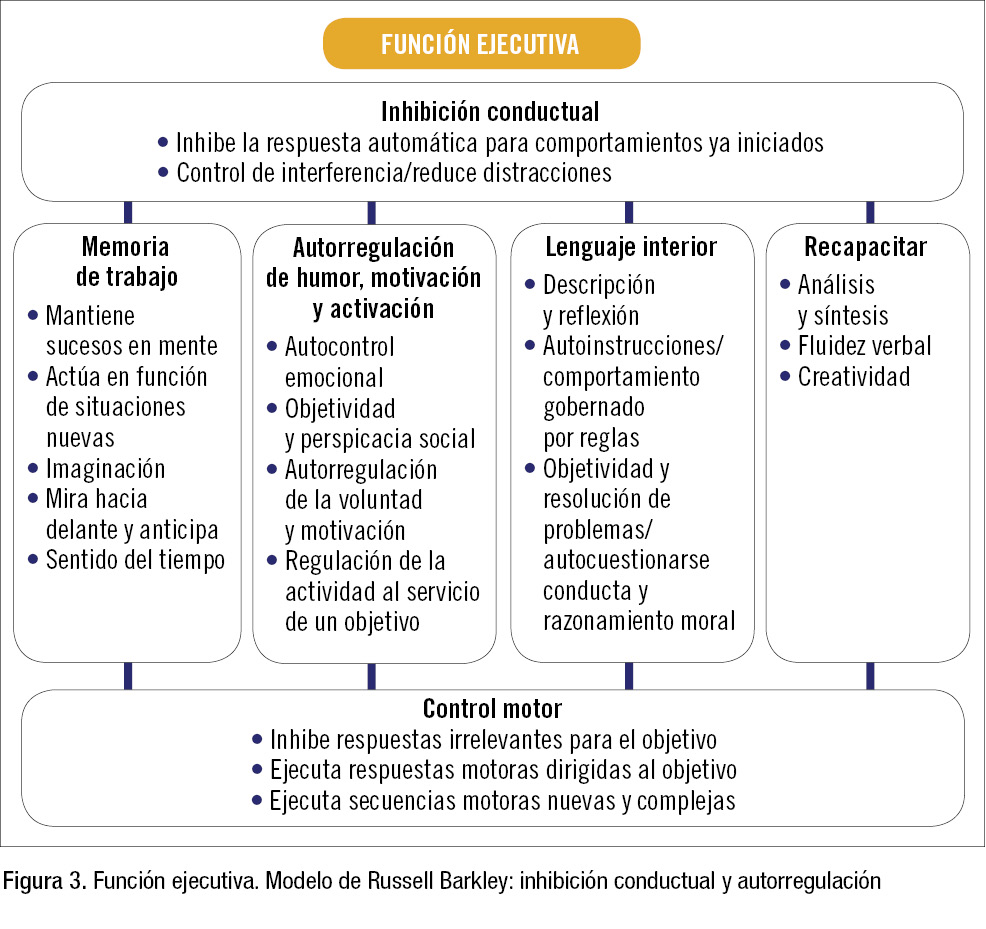
El modelo de Barkley se centra en la inhibición de la respuesta y las funciones ejecutivas (o autocontrol) (figura 3):
- Inhibición de la respuesta, compuesta por 3 partes: 1) inhibir la respuesta inicial o automática ante un estímulo, creando un retraso en la respuesta (para pensar antes de actuar); 2) interrumpir una respuesta ya iniciada, porque no está siendo eficaz, y 3) proteger la acción para obtener un objetivo frente a interferencias y distracciones.
- Funciones ejecutivas (o autocontrol). El autocontrol implica pensar en una consecuencia inmediata de nuestros actos, decidir que no es adecuada y cambiar el acto antes de hacerlo para conseguir otra consecuencia mejor. Se sirve de las siguientes funciones:
- Memoria de trabajo no verbal (ser consciente de uno mismo), que usa la vista y el oído, mediante la imaginación visual y auditiva, tanto retrospectivamente (recordando cosas que han pasado) como prospectivamente (imaginando qué puede pasar). Esto nos ayuda a predecir situaciones y tomar decisiones.
- Memoria de trabajo verbal (hablarse a uno mismo), que se desarrolla desde la infancia. Este lenguaje interior permite la reflexión, producir autoinstrucciones y autocorrecciones. Los niños con TDAH presentan un 33% de retraso en la internalización del lenguaje.
- Autorregulación del humor, la motivación, la activación y la intensidad de la emoción (sentimiento hacia uno mismo). Ayudada por las dos anteriores, permite decidir si mantenemos esa respuesta emocional ante una situación en privado o la expresamos al exterior. Los niños con TDAH tienen dificultades para retrasar su primera respuesta emocional, y suelen tener explosiones afectivas ante situaciones frustrantes. También implica la capacidad de automotivarse y mantener un trabajo hasta el final. Esta dificultad para terminar proyectos iniciados está presente con mucha frecuencia en los niños con TDAH.
- Reconstrucción (autojuego, fluidez, flexibilidad o generabilidad). La cuarta función ejecutiva es la capacidad de reconstruir mentalmente y generar diferentes combinaciones de unidades conductuales previas. Así se crean nuevas acciones de futuro, capacidad fundamental cuando la persona encuentra un obstáculo inesperado para llegar a un fin (un problema). Gracias a esta función se puede superar el problema.
Modelo de Brown: activación-concentración-esfuerzo, emoción-memoria-acción
Brown añadió dos aspectos importantes, la motivación y la regulación de la emoción, mencionados ya por Barkley, pero en los que hace mayor hincapié. El niño con TDAH puede prestar atención a ciertas cosas, como videojuegos, deportes o TV, y parece que es un problema de «voluntad» más que de atención. Esta diferencia se explica porque cuando hay gran motivación o un interés especial, el niño puede «reclutar» su capacidad de atención. El modelo tiene 6 bloques separados que funcionan al unísono y ayudan al individuo a gobernar su vida:
- Activación. Es lo que se hace antes de empezar a trabajar. Implica organizar las tareas, el material, estimar el tiempo, priorizarlas y empezar a hacer una de ellas. Los pacientes con TDAH posponen las tareas y lo dejan todo para el final, y les cuesta mucho empezar una cosa. Parece que no consiguen activarse hasta que tienen estrés.
- Concentración. Mantener la concentración y cambiar de tarea sin dejar de concentrarse son funciones que están alteradas en los niños con TDAH. Se distraen con facilidad por estímulos externos y sus propios pensamientos, que les hacen con frecuencia «soñar despiertos».
- Esfuerzo. Las funciones de mantener el esfuerzo, la alerta y seguir procesando información con velocidad son capacidades que también están alteradas en los niños con TDAH. Pueden acabar proyectos cortos o que requieren poco tiempo, pero tienen grandes dificultades en los que requieren un trabajo mantenido y no pueden completar en poco tiempo.
- Emoción. Los criterios DSM-5 no hacen referencia a síntomas emocionales, pero los niños con TDAH suelen tener una gran dificultad para manejar sus frustraciones y modular sus emociones, y demandan una satisfacción inmediata.
- Memoria. Las personas con TDAH pueden tener muy buena memoria a largo plazo, pero les resulta difícil recordar algo reciente, como dónde acaban de dejar una cosa o lo que iban a decir. Les cuesta mantener una idea en la cabeza mientras están atendiendo a otras cosas. Además, suelen tener «problemas de acceso a la memoria», y no recuerdan algo rápidamente, cuando lo necesitan, aunque se acuerden después.
- Acción. Los niños con TDAH, aunque no presenten hiperactividad, tienen problemas en regular sus acciones. Son impulsivos al hablar, hacer algo o pensar, llegando prematuramente a conclusiones erróneas. Tampoco se automonitorizan, no tienen en cuenta el contexto ni evalúan bien las respuestas de otros. Les cuesta regular el ritmo de sus acciones, no pueden frenar cuando es necesario o acelerar para terminar una cosa a tiempo.
Modelo de trastorno evolutivo del control de la frustración de Greene
Según Greene, hay muchos niños con TDAH que tienen una dificultad evolutiva en el control de su frustración. Son niños inflexibles y explosivos. No son capaces de tolerar situaciones frustrantes ni pueden pensar de forma clara. Cuando encuentran un problema o una situación que no saben resolver, «el sistema se recalienta», se frustran más allá de lo normal y, al no poder responder de manera eficaz, tienen una explosión o tormenta afectiva. Por ejemplo, en los niños de 2 años son frecuentes las rabietas, pero según van creciendo desarrollan poco a poco una mayor capacidad de esperar, de ser flexibles y de resistir a las frustraciones sin tener una rabieta.
Una vez que empieza la explosión, el niño ha pasado al punto de no retorno y no sirve de nada reñirlo o castigarlo. El objetivo de la intervención es evitar que la situación se deteriore más allá del punto de no retorno. Las actuaciones se diferencian en 3 tipos: 1) situaciones importantes y peligrosas, en que se hace lo que dicen los padres aunque el niño tenga una explosión (p. ej., cruzar la carretera el niño solo); 2) situaciones no importantes ni peligrosas, en que se hace lo que quiere el niño, sin entrar en discusiones inútiles, y 3) situaciones intermedias, en que hay que negociar con el niño para llegar a una solución del problema aceptable por ambas partes.
Modelo neuropsicológico integrado de TDAH
Los hallazgos en neuroimagen estructural y funcional han hecho retocar el modelo inicial de Barkley, añadiendo otras funciones neuropsicológicas que están alteradas en el TDAH, y que no residen en la corteza prefrontal. Así, han ganado importancia los ganglios basales y el sistema límbico de regulación emocional, aspectos que ya se recogen en los modelos de Brown y Greene.
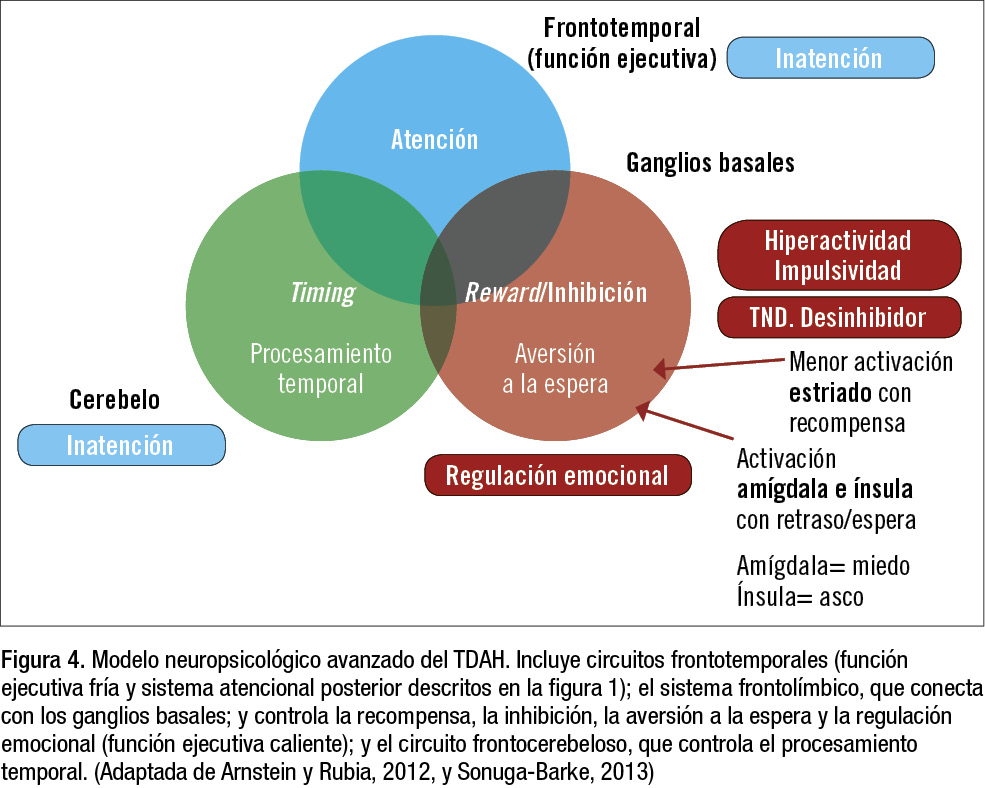
Además de la distribución anterior-posterior (figura 1), se propone una distribución superior-inferior o dorsal-ventral. En la parte más superior o dorsal del cerebro estaría el córtex prefrontal, con control top-down, o de arriba a abajo de atención y pensamiento, donde se originarían los síntomas de inatención. En un área intermedia estaría la zona de inhibición de acciones inapropiadas, con conexiones al córtex premotor, los ganglios basales y el cerebelo, donde se originarían los síntomas de impulsividad/hiperactividad y los de trastorno negativista (TND), según el modelo de aversión a la espera de Sonuga-Barke. En la zona más inferior o ventral, en el córtex prefrontal ventral, la zona más orbital del lóbulo frontal, con conexiones hacia la amígdala, estaría la zona de regulación emocional. Allí se originan los síntomas de disregulación emocional, según el modelo de Sergeant. Diferentes zonas de la amígdala controlan la respuesta de parálisis, o freezing, la subida de presión arterial, la liberación de hormonas de estrés y el reflejo de sobresalto (startle). El circuito es el siguiente: sentidos-tálamo-amígdala, un «atajo» rápido y con menos detalle que alerta rápido de un peligro, sin pasar por el córtex; por otro lado, sentidos-tálamo-córtex-amígdala, que es más lento pero manda la información con más detalle y ya de forma consciente (percepción del miedo).
El último cambio en el modelo consiste en englobar la zona de inhibición de respuesta y la de regulación emocional en un núcleo que controla la recompensa (reward) y la inhibición, y añadir otro núcleo importante de procesamiento temporal, que estaría centrado en el cerebelo (figura 4).
Los pacientes con TDAH presentan una menor activación del estriado (principalmente del nucleus accumbens) ante una recompensa, y si tienen que esperar a un premio, activan áreas límbicas como la amígdala (donde reside el sentimiento de miedo) y la ínsula (donde reside el sentimiento de asco). Por tanto, no procesan bien la espera para una recompensa mayor, y tienden a elegir recompensas menores pero inmediatas, según el modelo de Sonuga-Barke.
Finalmente, el modelo de fenotipo extendido de función ejecutiva (Barkley, 2012), además de los 3 circuitos revisados, incluye los siguientes:
- Circuito frontoestriatal (función ejecutiva fría de Rubia y memoria de trabajo).
- Circuito frontocerebeloso, que explica la ceguera del tiempo en el TDAH.
- Circuito frontolímbico de regulación emocional (niño explosivo de Greene y disregulación emocional de Sergeant, o función ejecutiva caliente de Rubia), que procesa la motivación y la recompensa en función del tiempo (aversión a la espera de Sonuga-Barke).
- Circuito DLPFC-parieto-temporal-cíngulo anterior-límbico, que controla la automonitorización/introspección, cuarto circuito desde el córtex prefrontal dorsolateral.
Genética del TDAH
La evidencia de que el TDAH tiene una etiología genética parte de los siguientes datos:
- El riesgo de padecer TDAH se multiplica por 12-16 si el hermano gemelo homocigoto tiene TDAH, por 5-8 si lo sufren familiares de primer grado (padres o hermanos, incluidos gemelos heterocigotos) y por 2 si lo tienen familiares de segundo grado (primos, tíos, etc.). El 57% de los pacientes tienen un familiar de primer grado con TDAH.
- Los estudios de adopción permiten discriminar el efecto del ambiente del de los genes. Los hermanos biológicos de pacientes con TDAH presentan un mayor riesgo de TDAH que los hermanos no biológicos (comparten sólo el ambiente). Los niños adoptados en familias con TDAH no tienen un riesgo mayor de padecer TDAH que los niños controles.
- El grado de concordancia del TDAH entre gemelos homocigotos (idénticos) es mayor que entre los heterocigotos (no idénticos o mellizos). Una mayor concordancia en gemelos heterocigotos es indicativa de una mayor influencia de los genes que del ambiente. La heredabilidad media del TDAH es del 75%.
Se han asociado múltiples genes implicados en el TDAH, pero sólo 7 se han replicado: 4 se han implicado en la vía dopaminérgica –dopamina β hidroxilasa (DBH), transportador de dopamina (DAT1) y los receptores de dopamina D4 y D5 (DRD4 y DRD5)– y los otros 3 son el receptor de serotonina 1B (HTRB1), el transportador de la serotonina (SCLC6A4/5HTT) y el SNAP25 (proteínas implicadas en la exocitosis de neurotransmisores de vesículas de almacenamiento). El mecanismo genético es complejo, la herencia es poligénica (están implicados varios genes, cada uno de ellos con escasa penetrancia) y los genes interaccionan entre ellos y con el ambiente.
Imagen cerebral en el TDAH
En las últimas décadas se han realizado muchos estudios que demuestran alteraciones consistentes en la estructura y la función del sistema nervioso central (SNC) en pacientes con TDAH desde la niñez hasta la edad adulta. Estas alteraciones podrían estar determinadas por los factores individuales de cada paciente y ser reconducibles con la instauración de un tratamiento adecuado.
Neuroimagen estructural
La principal técnica de imagen para el estudio preciso de la anatomía cerebral es la resonancia magnética (RM). Hay muchos estudios comparativos del grosor y el volumen de la corteza cerebral en pacientes con TDAH frente a los controles sanos, que han encontrado reducciones volumétricas replicadas en diferentes áreas y núcleos del cerebro y el cerebelo. Shaw et al. encontraron un retraso de 2-3 años en el desarrollo del grosor cortical en niños y adolescentes con TDAH, comparados con los controles, en general, pero especialmente en las áreas prefrontales y el cíngulo. También se encontraron retrasos en el desarrollo de la corteza temporal, parietal, occipital, giro angular y supramarginal, área motora suplementaria y cúneo y precúneo. Muchos de ellos correlacionaron el ritmo de desarrollo cortical con la intensidad de síntomas nucleares del trastorno, observándose una mayor alteración en las trayectorias de desarrollo cortical en pacientes e individuos sanos con mayores puntuaciones en síntomas de inatención. Se ha descrito que la edad y el tratamiento con medicación estimulante tendían en muchos casos a la normalización de las trayectorias de desarrollo hasta converger con una maduración cerebral normal. Los metaanálisis de Katya Rubia encontraron un menor volumen en los ganglios basales en los pacientes con TDAH, comparados con los controles sanos, y mejoraban en los estudios en que los pacientes tomaban la medicación (estimulantes) un 75-100% del tiempo, y también con la edad. En un metaanálisis muy reciente, que incluía a 1.713 participantes con TDAH y 1.529 controles, con una mediana de edad de 14 años (rango: 4-63), realizado en 23 centros en todo el mundo, los volúmenes del núcleo accumbens, la amígdala, el caudado, el hipocampo y el putamen, así como el volumen total intracraneal, eran menores en las personas con TDAH que en los controles sanos. Estas diferencias eran mayores en los niños (<12 años) que en los adultos (>21 años) en todas estas zonas, lo que sugiere un retraso en la maduración en estas zonas, que en parte se corrige con la edad.
Los estudios sobre la sustancia blanca mediante el uso de imagen por difusión de tensión (DT) han observado una alteración de la conectividad estructural entre áreas cerebrales. Por otro lado, en los niños con TDAH existen una mayor actividad funcional de la red de activación por defecto (deafult mode network) y una menor capacidad de inhibirla ante un estímulo entrante importante (target). Esta red está activada cuando no se piensa en nada; es la actividad en reposo del cerebro y debe inhibirse para poder atender a un estímulo entrante.
Neuroimagen funcional y de conectividad cerebral
La investigación por neuroimagen en el TDAH también ha comprendido el estudio dinámico de la funcionalidad cerebral y la conectividad en actividad y reposo entre estructuras cerebrales. Las técnicas empleadas han sido la tomografía por emisión de positrones (PET) y la tomografía computarizada de emisión monofotónica (SPECT). También se ha usado la resonancia magnética funcional (RMf), que determina la activación de áreas cerebrales tanto ante la realización de actividades como en reposo. Se ha descrito una hipoactivación en áreas frontales, parietales y estriatales en niños y adultos con TDAH con respecto a controles sanos. Las áreas implicadas están relacionadas con las funciones ejecutivas, del circuito motivacional y de recompensa y cognición temporal, entre otras. Se ha estudiado también la influencia del tratamiento farmacológico, y se ha hallado una normalización de la activación de las áreas frontoestriatales ante tareas de inhibición de interferencias. Recientemente, un estudio pionero de Newcorn ha encontrado una correlación entre una activación mayor del núcleo caudado ante una tarea de inhibición de respuesta como predictor de mejor respuesta a metilfenidato (MTF) pero no a atomoxetina (ATX).
Sistema de activación por defecto en el TDAH
El sistema de activación por defecto (DMN) conecta de delante hacia atrás la corteza prefrontal anteromedial, la corteza cingular anterior, la corteza prefrontal dorsomedial y la corteza medial temporal, y parece responsable de los procesos de cognición autorreferencial (introspección y automonitorización) y de proyección al futuro (predicción de consecuencias y sentimientos derivados de nuestras acciones). El DMN se desarrolla desde la infancia hasta la adolescencia y la vida adulta, aumentando gradualmente las conexiones a distancia. El DMN tiende a una correlación inversa de activación con otras redes de funciones específicas, como las encargadas de las tareas de atención sostenida (target). Así, la activación de estas últimas implica una supresión o inhibición del DMN, y la activación del DMN las suprime (si estamos pensando en «nada», no estamos atendiendo).
En resumen, la evidencia indica que el TDAH es un trastorno del neurodesarrollo caracterizado por un retraso y un fallo en la maduración de la sustancia gris en la corteza cerebral (sobre todo prefrontal y cingular), y de la sustancia gris en los ganglios basales; las alteraciones en el desarrollo de los tractos nerviosos cerebrales (sustancia blanca), y la alteración en la conectividad funcional de redes neuronales, en particular las frontoparietales y el DMN. Es un trastorno cuyo origen podría remontarse a las primeras fases del desarrollo embrionario y prenatal, y cuya expresión clínica varía y evoluciona durante la infancia, la adolescencia y la edad adulta, en función tanto de las demandas del ambiente como de las adaptaciones que el paciente puede realizar al interaccionar sus dificultades con el ambiente.
Hay una importante convergencia entre los modelos neuropsicológicos, los hallazgos genéticos y los hallazgos de neuroimagen. Existen alteraciones neuropsicológicas sobre la atención, las tareas ejecutivas, la motivación y recompensa y el control de impulsos. Este desarrollo evolutivo de la enfermedad es susceptible de normalización o mejora con el tratamiento farmacológico, pedagógico y conductual, así como con adaptaciones ambientales.
Manifestaciones clínicas del TDAH
Los síntomas clínicos varían desde simples a más complejos, y se manifiestan de forma diferente según la edad, el sexo, el contexto en el cual se desarrolla el paciente, las características propias y la presencia de comorbilidad. Con la edad disminuyen todos los síntomas, sobre todo la hiperactividad y la impulsividad, pero la inatención es la característica que más perdura en el tiempo. Las niñas con TDAH suelen presentar menos hiperactividad/impulsividad y agresividad que los niños. Los síntomas dependen del contexto, ya que disminuyen en situaciones muy organizadas, estructuradas, novedosas e interesantes, y aumentan en situaciones que requieren atención y un esfuerzo mental mantenido y que carecen de novedad y atractivo. Además, los síntomas disminuyen cuando hay una supervisión individual (de los padres o profesores) o se gratifica a los niños con frecuencia por su buen comportamiento, y suelen empeorar en un contexto grupal.
Los síntomas nucleares (inatención, hiperactividad e impulsividad) se recogen en la tabla 1 (DSM-5), y además existen otras dificultades asociadas:
- Dificultades para relacionarse con sus iguales y con los adultos. Presentan comportamientos desinhibidos, insisten en satisfacer sus necesidades y no piensan sus acciones; por ello, surgen conflictos con el entorno, son impopulares, con amigos poco duraderos, y a veces se aíslan.
- Problemas en el aprendizaje. Debido a la dificultad para organizarse y la escasa memoria de trabajo, presentan dificultades en el lenguaje, la lectura, la escritura y el cálculo matemático.
- Rendimiento académico por debajo de su capacidad. Un niño con TDAH con un coeficiente intelectual normal o alto puede sacar notas muy ajustadas, suspender, requerir refuerzo escolar, adaptación curricular, repetir curso e incluso abandonar los estudios.
- Dificultad para la expresión verbal, por no ordenar sus ideas antes de transmitir el mensaje.
- Torpeza motora fina (mala caligrafía) y gruesa (niño torpe y malo en los deportes).
- Escasa tolerancia a la frustración, por lo que puede reaccionar con irritabilidad o labilidad emocional.
- Mal manejo del tiempo, lo que le lleva a presentar dificultades académicas y de relación social.
- Tendencia a una autoestima baja, por las repercusiones negativas de sus síntomas en todas las áreas de funcionamiento.
- Tendencia a involucrarse en conductas de riesgo, por comportamientos impulsivos: consumo de drogas, conducir a gran velocidad (accidentes de tráfico), inicio temprano de la actividad sexual (riesgo de infecciones sexuales, embarazo y paternidad precoz), peleas y violencia.
Evaluación diagnóstica
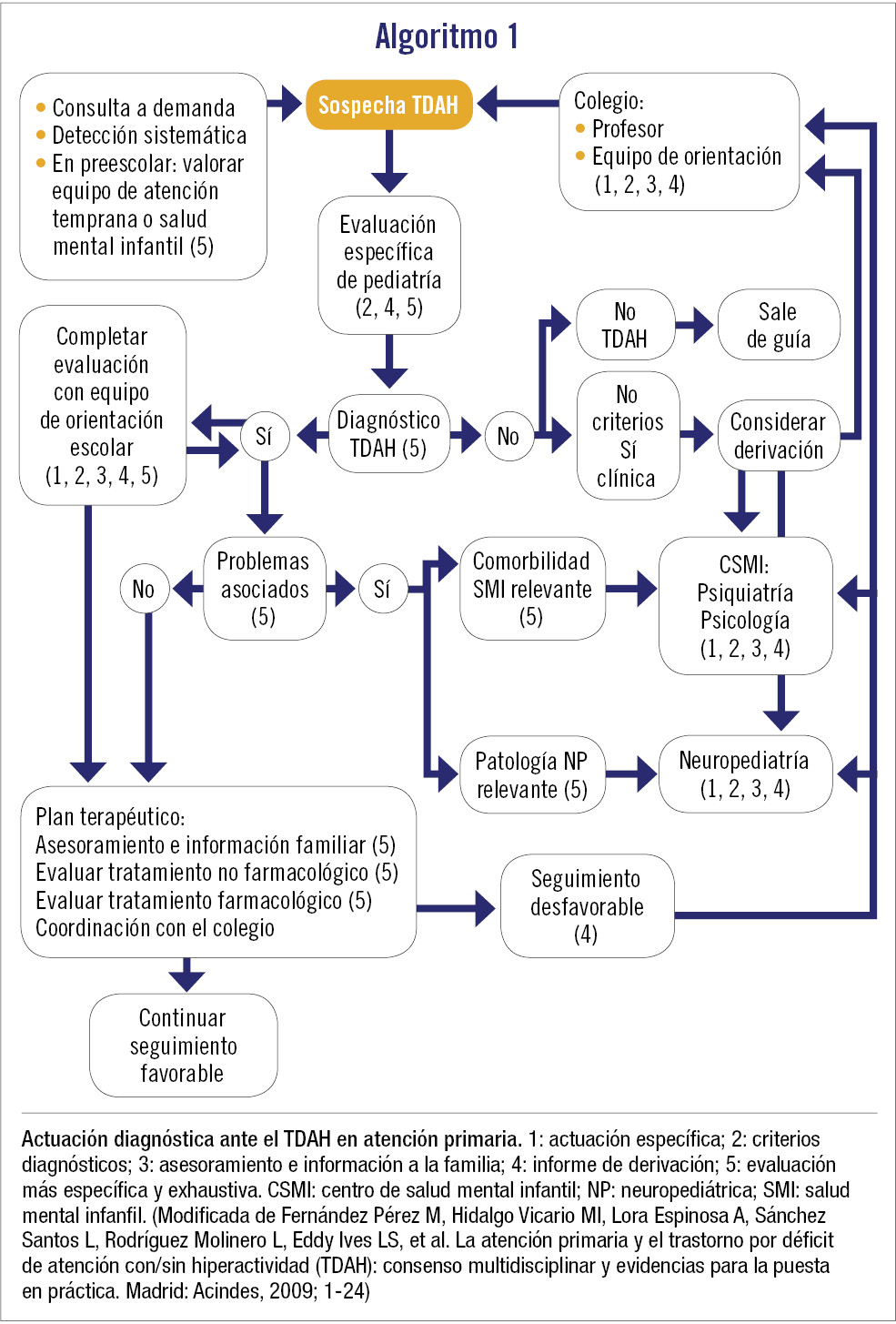
Según las diferentes guías de práctica clínica (GPC), el diagnóstico del TDAH es exclusivamente clínico. Se basa en una historia clínica detallada que investigue los síntomas clínicos específicos del trastorno. Es necesario obtener evidencias directamente de los diferentes entornos, sobre todo familiar y escolar. No existe ningún marcador psicológico o biológico, prueba o test patognomónico del trastorno. En el algoritmo 1 se expone la evaluación diagnóstica por el pediatra de atención primaria.
Historia clínica
Se indagará sobre los síntomas nucleares, la edad de inicio, la duración, el contexto o los contextos en que presenta los síntomas, la evolución y la repercusión sobre el funcionamiento del niño y su familia. Se deben investigar los antecedentes personales, el embarazo (exposición a drogas, infecciones u otros problemas), el parto y el periodo perinatal y posnatal (prematuridad, sufrimiento fetal, hipoxia, hipoglucemia o malformaciones). Interesa saber cómo ha sido el desarrollo madurativo psicomotor y social, si hubo fertilización in vitro, si el niño fue adoptado y su nacionalidad. Se debe recoger información sobre la posible existencia de enfermedades médicas previas, como infecciones, traumatismo craneoencefálico, problemas neurológicos, trastornos del sueño y posible comorbilidad psiquiátrica. Se valorará el funcionamiento psicosocial del paciente en la familia, en la escuela y con los amigos.
En atención primaria es muy fácil realizar la detección precoz del TDAH en los exámenes periódicos de salud. Para ello se pueden realizar ciertas preguntas, como ¿qué tal le va en el colegio?, ¿va contento?, ¿han detectado problemas de aprendizaje?, ¿cómo es el comportamiento en el colegio, en casa y con los amigos?, ¿tiene problemas para terminar las tareas escolares? Además, dado el fuerte componente genético, se investigarán los antecedentes familiares en los padres sobre enfermedades médicas o psiquiátricas, así como el funcionamiento familiar y la posible presencia de maltrato, trauma o abandono. Es conveniente entrevistar al propio paciente, además de con la familia, de forma individual, valorando los apoyos del entorno y cómo percibe y explica sus síntomas.
Las GPC resaltan las recomendaciones para la evaluación, generalmente entre los 6 y los 12 años; sin embargo, los síntomas clínicos varían su expresión desde la lactancia hasta la adolescencia y la edad adulta:
- En los niños pequeños, de 1-3 años de edad, el diagnóstico es muy difícil. Suelen ser lactantes irritables con variación temperamental, que tienen problemas para dormir, gases o cólicos; posteriormente, se observa una marcada impulsividad, con una adaptación social limitada, en la interacción de estos niños con la familia y el entorno. No obedecen, no respetan las normas y molestan. Suelen presentar alteraciones del sueño, del lenguaje y del desarrollo motor.
- En los preescolares, de 3-6 años de edad, puede observarse una menor intensidad y duración en el juego; prefieren los juegos deportivos, desmontar y destrozar juguetes; presentan inmadurez emocional, gran inquietud motora, déficit en el desarrollo, conducta desafiante, problemas de adaptación social, accidentes y dificultades en la coordinación motora, con problemas de aprendizaje (con los colores, números y letras, así como en la comprensión de la figura humana en el dibujo). El diagnóstico sigue siendo difícil, ya que la hiperactividad, la impulsividad y el déficit de atención pueden ser propios de la edad. Es importante valorar si se afectan la socialización, el aprendizaje y la interacción padres-hijos.
- En la etapa escolar (6-12 años) suele ser cuando aumentan las consultas a los profesionales de la salud. Éste es el grupo de edad para el que se dispone de la mejor evidencia científica, tanto para el diagnóstico como para el tratamiento. Los síntomas nucleares se manifiestan de forma más clara. Los niños son rechazados por sus compañeros y hermanos, y sufren las reprimendas de padres y profesores, por lo que se lesiona su autoestima. Todo ello contribuye a exacerbar la sintomatología.
- En la adolescencia disminuye la hiperactividad y se mantiene cierto grado de inquietud interna e impaciencia, mientras que la inatención suele ser más notoria. Son frecuentes los problemas académicos, la baja autoestima, el aumento de la comorbilidad, los problemas de comportamiento con la familia y el entorno y un aumento de las conductas de riesgo: consumo de drogas, sexo arriesgado, accidentes, violencia, delincuencia, riesgo de suicidio… En esta época se superponen las manifestaciones propias de la adolescencia (inseguridad, presentismo, predominio de la acción sobre la reflexión, invulnerabilidad, rechazo de las normas adultas…) con las manifestaciones de un posible TDAH y el incremento de la comorbilidad. Además, los pacientes pueden referir menos afectación de los síntomas nucleares (se acostumbran), y la información de padres y profesores es menos fiable (menos tiempo en casa y mayor número de profesores). Por ello, reconocer durante esta etapa el TDAH es más complicado y puede requerir la ayuda de otros profesionales.
- El 40-60% de los pacientes mantendrá en la edad adulta cierta inestabilidad emocional, un mayor riesgo de problemas familiares y laborales, un menor nivel socioeconómico del previsto por su potencial y diversas patologías psiquiátricas que ocultan el TDAH de base (abuso de drogas, ansiedad, depresión, trastorno bipolar, antisocial o límite de la personalidad).
Exploración física
En ella se incluirán la medición del peso, la talla, la presión arterial, el pulso, la visión y la audición, así como una evaluación de signos dismórficos y anomalías cutáneas, y una exploración neurológica. Se pueden observar signos que orientan a determinados síndromes que cursan con TDAH, como el síndrome de X frágil o el de alcoholismo fetal. También es preciso conocer el estado del paciente antes del posible inicio de un tratamiento farmacológico y valorar posteriormente si aparecen efectos secundarios.
Observación del paciente en diferentes contextos (casa, colegio, actividades de ocio)
Los síntomas pueden no aparecer en una entrevista rutinaria, y pueden ser necesarias varias consultas para una adecuada evaluación. Hay que tener presente que los síntomas varían según el contexto. Es de gran ayuda obtener información de diferentes ámbitos, y también si hay discrepancias entre padres y profesores (diferentes expectativas, estructuras o estrategias de conducta).
Escalas y cuestionarios
El uso de escalas y cuestionarios autoaplicados para padres, profesores y el propio evaluador ayudan, junto con la entrevista, en la evaluación del paciente. Nunca se realizará el diagnóstico exclusivamente mediante la evaluación de cuestionarios. Se dispone de 2 tipos de instrumentos: unos dirigidos específicamente hacia el TDAH (derivados de los criterios del DSM), y otros más amplios e inespecíficos para realizar una evaluación más general del paciente. Entre los primeros, se dispone del cuestionario de evaluación del TDAH de Du Paul (1998) para niños de 5-17 años, que cuenta con una versión para padres y profesores, y fue validado en nuestro país por Servera y Cardo en 2008. El test de Conners y el SNAP-IV están igualmente validados para la población española. Entre los segundos se incluyen el SDQ (Strengths and Difficulties Questionnaire) de Goodman (disponible gratuitamente en: https://www.sdqinfo.org) y el CBCL (Child Behavior Checklist) de Achenbach, que explora las dificultades en diversos ámbitos. Puede ser necesario utilizar cuestionarios específicos de depresión o ansiedad, entre otros.
Evaluación neuropsicológica
No puede usarse para confirmar o descartar el TDAH, sino que se utiliza para apoyar la evaluación clínica, dar información sobre la situación del paciente (capacidad cognitiva, lectura, escritura, atención, planificación, flexibilidad cognitiva…), realizar el diagnóstico diferencial y como apoyo terapéutico. Entre las posibles herramientas, destacan el Continuous Performance Test (CPT), el Stroop Color-Word Interference Test (SCWT), el Test de Copia y Reproducción de una Figura Compleja de Rey-Osterrieth, los dígitos directos e inversos, el Test de Caras, etc. En muchas ocasiones, será preciso realizar una evaluación psicométrica y determinar el coeficiente intelectual con la Escala Wechsler de Inteligencia para Niños (WISC). Actualmente, esta evaluación la realiza el equipo de orientación psicopedagógica escolar, que facilita su disposición para el pediatra. Se puede realizar una exploración cognitiva en la consulta:
- Pedir al niño que nos relate un evento reciente: cumpleaños, actividad deportiva, libro, película… Así se valora si el lenguaje es fluido, coherente y organizado. Se le puede pedir que siga un orden de 3 pasos (secuencia); que nos repita 4 palabras, las recuerde y las repita de nuevo cuando se le pregunte en 5 o 10 minutos; que lea un texto y lo resuma, cálculo mental… (memoria, atención, concentración).
- Observar al niño utilizando un lápiz para copiar símbolos y palabras (motricidad viso-perceptiva).
- Evaluar los cuadernos escolares y las evaluaciones de los profesores.
Pruebas complementarias
Siempre que tras una adecuada historia clínica se demuestre su pertinencia para el diagnóstico, se pueden realizar diversas pruebas: hemograma, metabolismo del hierro, perfil hepático, estudio hormonal tiroideo, electrocardiograma (ECG), polisomnografía, electroencefalograma (EEG), análisis genético o pruebas de neuroimagen (estas 2 últimas se utilizan en investigación científica).
Comorbilidad
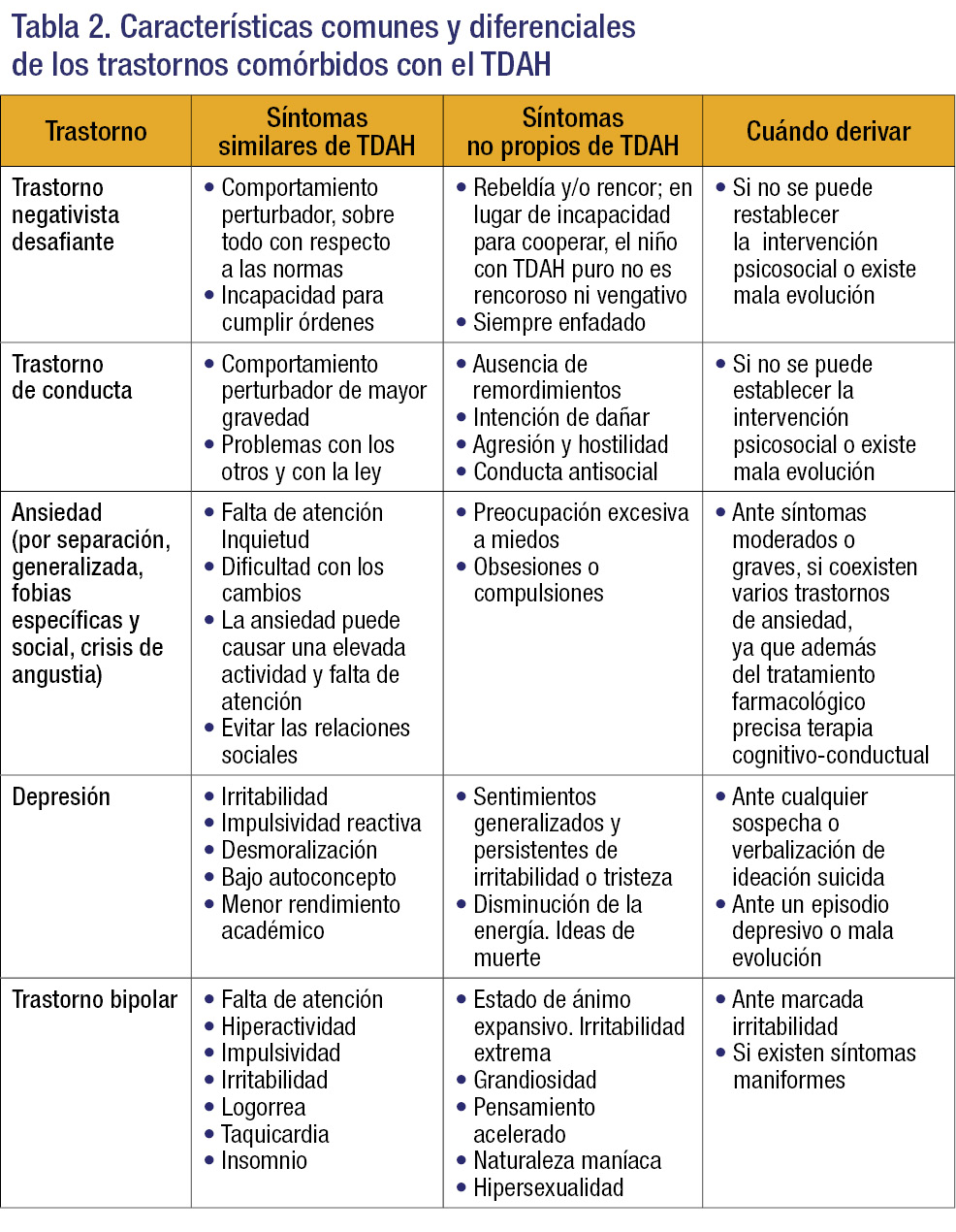
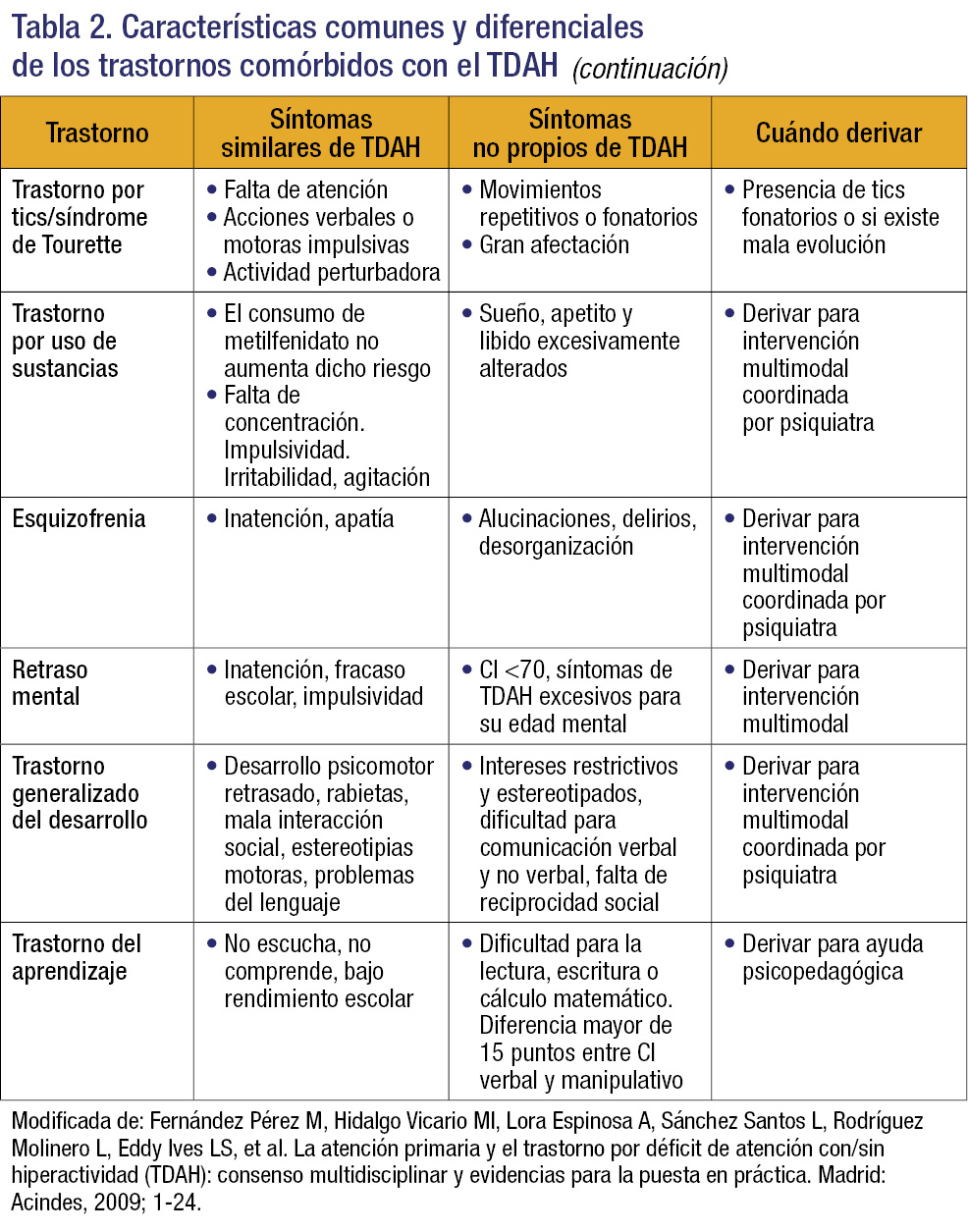
Se debe tener presente que la comorbilidad es la norma y no la excepción en el TDAH. El 70% de los pacientes con TDAH presenta, al menos, un trastorno psiquiátrico y el 40% dos, lo que condiciona la complicación del diagnóstico, la evolución del trastorno y una menor respuesta al tratamiento. Los trastornos asociados con más frecuencia, así como las manifestaciones similares o diferentes del TDAH y cuándo derivar al paciente, se recogen en la tabla 2.
Diagnóstico diferencial
Se tendrán en cuenta los procesos médicos, neurológicos, psiquiátricos, y otros recogidos en la tabla 3.
A veces, es difícil realizar el diagnóstico debido a la superposición de síntomas y a que, hasta en el 70% de los casos, el TDAH se asocia a uno de estos trastornos, que requieren un tratamiento simultáneo.
Tratamiento
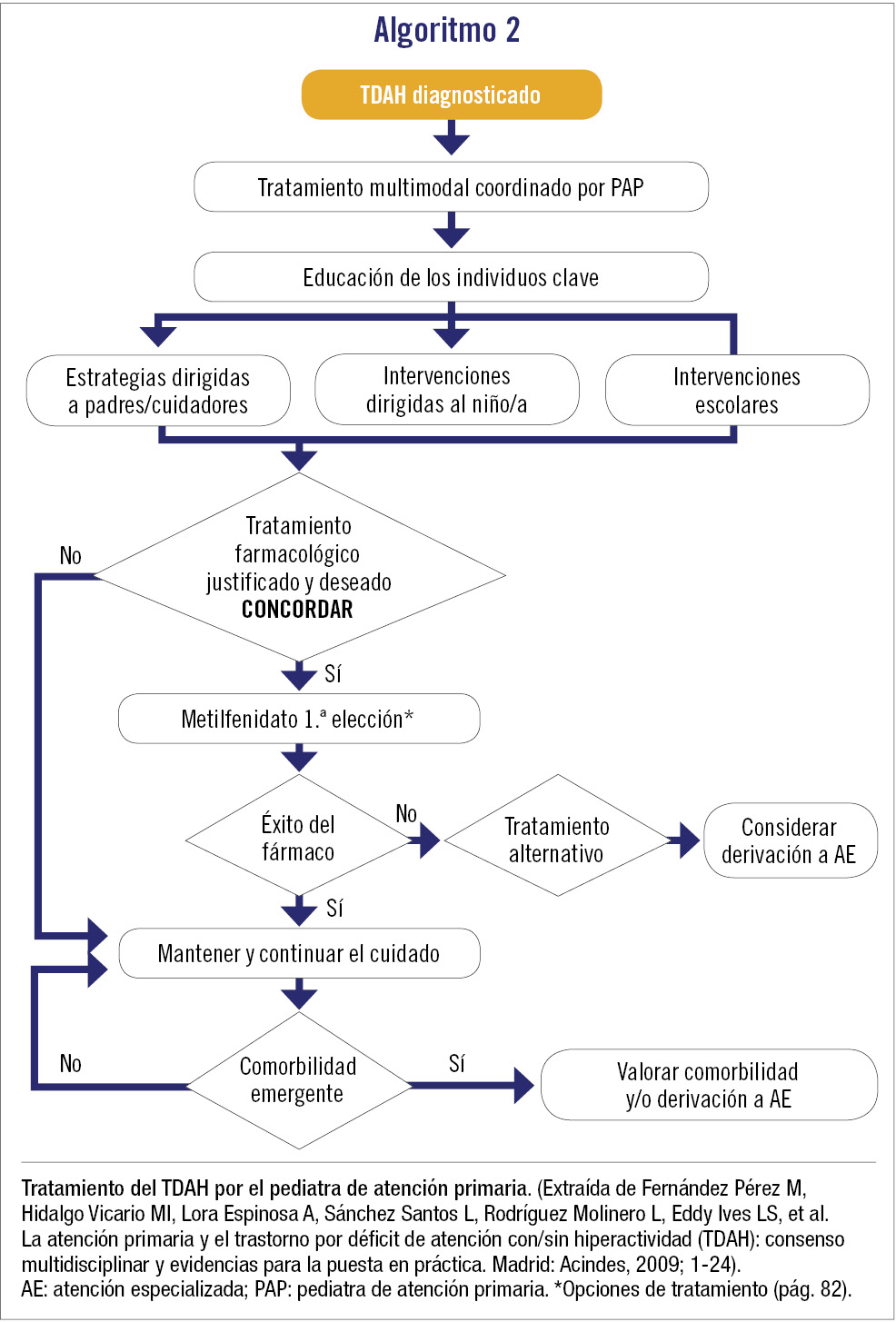
El tratamiento del TDAH es multimodal, e incluye un abordaje farmacológico y no farmacológico (psicosocial) con diferentes modalidades terapéuticas basadas en la evidencia científica y realizada por diferentes profesionales. En el algoritmo 2 puede observarse la actuación del pediatra de atención primaria. El tratamiento comprende 3 pilares fundamentales: 1) psicoeducación y manejo conductual por parte de los padres; 2) apoyo académico, y 3) tratamiento farmacológico.
Psicoeducación y manejo conductual por parte de los padres
Consiste en que los padres y el propio chico comprendan en qué consiste el TDAH y cuáles son sus síntomas (tanto los nucleares como los secundarios que modulan la gravedad del cuadro) para ayudar en la resolución de éstos, así como evitar la aparición de la comorbilidad asociada. Se les proporcionará una información adecuada, se llevarán a cabo entrenamientos y se aclararán errores. Deberán colaborar con los profesores y los profesionales.
Las intervenciones conductuales que pueden realizar los padres son: refuerzos y castigos, extinción, economía de fichas, contrato de contingencias… Es importante contar con una estructura adecuada (organizar las tareas, rutinas, horarios regulares de comida, sueño, ejercicio-ocio, eliminar las interferencias…). Antes de aplicar las intervenciones se debe valorar la conducta anómala, así como su intensidad, frecuencia y evolución en el tiempo. Tales intervenciones deben aplicarse de forma continuada, coordinando los diferentes entornos y aclarando que es un aprendizaje y no un castigo. Se tendrán en cuenta los factores culturales y psicosociales, la madurez y el temperamento del niño.
El terapeuta también realizará intervenciones conductuales sobre el paciente según las dificultades identificadas: intervención cognitivo-conductual, habilidades sociales, técnicas de resolución de problemas o estrategias de autoayuda.
Apoyo académico
Está dirigido, en gran medida, al entrenamiento neuropsicológico en las funciones del sistema ejecutivo (motivación, organización, planificación, flexibilidad cognitiva, memoria de trabajo, autoevaluación, etc.), así como a los ajustes necesarios durante las clases y las evaluaciones, y al apoyo específico de los trastornos de aprendizaje asociados, todo ello con el fin de mejorar el rendimiento y el comportamiento del paciente.
Los profesores también recibirán información y entrenamiento para las intervenciones conductuales y la aplicación de normas y límites, así como pautas para el apoyo escolar y mejorar la atención, la comprensión…, en colaboración con las familias y los profesionales.
Tratamiento farmacológico
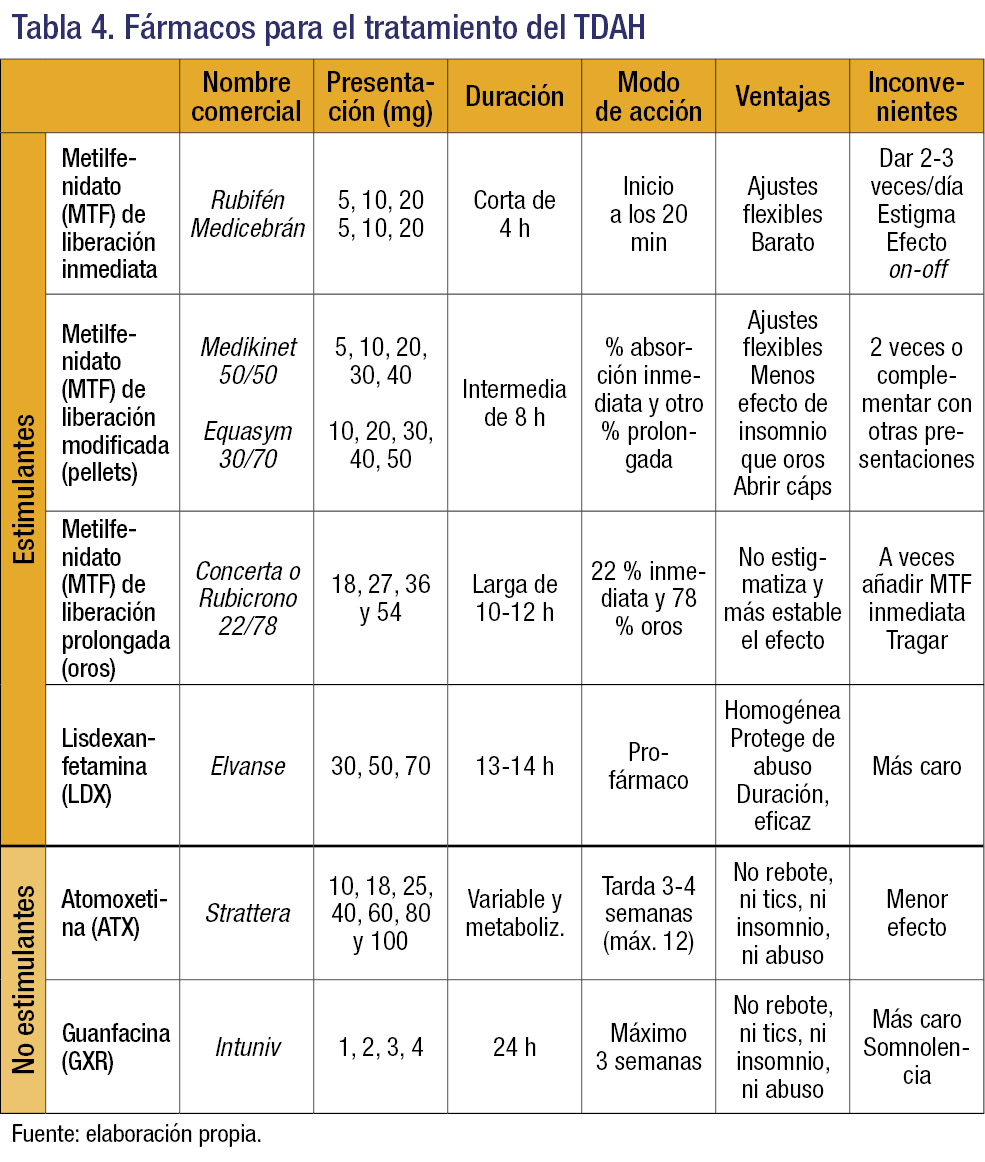
Es la medida más efectiva para la reducción de los síntomas nucleares. En España están aprobados para niños y adolescentes con TDAH los estimulantes metilfenidato (MTF) y lisdexanfetamina (LDX), y los no estimulantes atomoxetina (ATX) y guanfacina (GXR). En la tabla 4 se detallan las características de cada uno.
Estimulantes
Mecanismo de acción y efecto
El MTF inhibe la recaptación de los neurotransmisores en el espacio intersináptico. La LDX, además, favorece la liberación de neurotransmisores en las vesículas presinápticas aumentando la liberación de DA y NA al espacio intersináptico. Esta elevación de la DA disminuye el ruido y mejora la ratio señal/ruido.
Los estimulantes elevan la DA en el estriado, que media efectos motores, y también en el nuccleus accumbens, que media los posibles efectos de recompensa, y en el córtex prefrontal, que media los efectos terapéuticos beneficiosos sobre la atención y la memoria. El 60-75% de los casos de TDAH responde favorablemente al tratamiento con MTF; además de mejorar las características principales (hiperactividad, inatención e impulsividad), mejora la función social y cognitiva y la agresividad. El tamaño del efecto del MTF es de 0,9 a 1.
El MTF se presenta en forma de liberación inmediata (Rubifén® y Medicebrán®), cuyo efecto dura unas 4 horas, por lo que hay que dar 2-3 tomas al día; en cápsulas de liberación modificada en pellets 50:50 (Medikinet®) y 30:70 (Equasym®), cuyo efecto dura unas 8 horas (las cápsulas se pueden abrir y espolvorear en alimentos semisólidos); en forma de liberación prolongada por sistema osmótico OROS®-MTF 22:78 (Concerta® o Rubicrono®), y el genérico Metilfenidato Sandoz® en tabletas; estas formulaciones tienen un efecto que dura unas 12 horas, se deben tragar enteras y conllevan una mejor adherencia y menor estigmatización ya que se pueden tomar en casa. La dosis eficaz en niños suele estar entre 1 y 2 mg/kg/día, pero debe ajustarse de forma individual, subiendo gradualmente cada pocos días.
La LDX es una forma de dextroanfetamina conjugada con el aminoácido lisina, un profármaco. Tras administrarse, se absorbe en la sangre y, por acción de las enzimas en la pared del eritrocito, se separa la dexanfetamina de la lisina, activándose la medicación. LDX ofrece una mejor protección frente a una sobredosis de anfetamina y frente a un uso indebido de la medicación por otras personas. LDX está aprobada para el TDAH en niños a partir de los 6 años, cuando la respuesta al tratamiento previo con MTF se considera clínicamente inadecuada. Está disponible en cápsulas de 30, 50 y 70 mg/día, que se pueden abrir y disolver en agua para niños que no saben tragar cápsulas. Se recomienda empezar con 30 mg/día durante 1 semana, después 50 mg/día durante 1 semana, y posteriormente 70 mg/día valorando la respuesta. En niños pequeños, la dosis eficaz suele ser de 30 mg/día, en niños más mayores de 50 mg/día y en adolescentes de 70 mg/día.
Efectos adversos de los estimulantes
Un 10-15% de los niños presentan efectos adversos. Los más frecuentes son insomnio de conciliación, disminución del apetito, cefaleas y nerviosismo. Suelen ser leves y, generalmente, responden a cambios en la dosis o en el horario de toma. Si la disminución del apetito al mediodía produce una pérdida de peso, se reforzarán las otras comidas y se pueden añadir suplementos energéticos. El efecto rebote (empeoramiento brusco de los síntomas 3-5 h después de la última dosis) se tratará con dosis de liberación inmediata o con formulaciones de liberación prolongada.
- Posible afectación leve del crecimiento por la disminución del apetito. El TDAH, aunque no esté tratado, puede asociarse a retrasos constitucionales del crecimiento que se normalizan al final de la adolescencia. En el estudio MTA, la afectación del peso y la talla se produjo únicamente en los primeros 3 años de tratamiento, con una repercusión de sólo 2 cm en detrimento de la talla final. El efecto sobre la talla tiende a ser mayor en niños más pequeños (<12 años) en los primeros 2 años de tratamiento, si pierden peso. Generalmente, la talla que se «deja de ganar» en esos años se recupera más adelante. Hay estudios que indican que la talla final es igual o muy similar en los niños no tratados que en los niños tratados y en los controles. Se debe monitorizar el peso y la talla; reforzar la merienda y la cena, que es cuando la medicación afecta menos al apetito; tomar batidos energéticos suplementarios; usar la mínima dosis que sea eficaz y, en los casos donde haya un déficit de crecimiento, estimar la edad ósea y referir a los pacientes a la consulta de endocrinología pediátrica. También es bueno calcular la talla diana familiar, para comprobar si el percentil de talla del niño es adecuado según la talla del padre y la madre biológicos. El tratamiento los fines de semana no mejora el apetito ni la talla, y quizás lo empeora, al no llegar a acostumbrarse nunca el niño a su dosis.
- El 25-50% de los niños con TDAH presentan problemas de sueño previos al tratamiento. Si el paciente tiene insomnio secundario a la medicación, puede usarse melatonina.
- La presencia de un trastorno por tics, o síndrome de Tourette, no contraindica el uso de estimulantes, aunque éstos pueden empeorar los tics en algunos pacientes. Los tics son más frecuentes en niños con TDAH que en los controles sanos, y el inicio del TDAH es anterior a los tics, que suelen remitir antes que el TDAH. Si aparecen tics relacionados con el tratamiento, hay que investigar si están realmente relacionados con el estimulante, disminuir su dosis y, si no ceden, interrumpir el tratamiento y valorar cambiar a ATX.
- Seguridad cardiaca. Ningún estudio publicado ni la práctica clínica o los datos epidemiológicos han mostrado un riesgo superior al de la población general por el uso de estimulantes relacionados con problemas cardiovasculares, incluido el riesgo de muerte súbita. No es necesario realizar un ECG previo al tratamiento. En los niños con cardiopatías o arritmias conocidas se debe realizar una completa historia clínica y consultar al cardiólogo pediátrico.
- Síntomas psicóticos. Excepcionalmente, y si hay predisposición genética, 1 de cada 1.000 pacientes en tratamiento con MTF pueden presentarlos (aumentan la actividad dopaminérgica cerebral).
- Los estimulantes no aumentan el riesgo de abuso de sustancias, pero un paciente puede utilizarlos en dosis superiores a las prescritas para obtener un efecto euforizante. Se debe valorar el riesgo de abuso por parte del paciente o su familia antes de prescribirlos, y usar formas de liberación prolongada, que tienen un menor riesgo, al no poder triturarse ni tomarse por vía intravenosa o intranasal.
No estimulantes
La falta de respuesta o los efectos adversos de los estimulantes (en un 10-30% de los pacientes con TDAH), así como el potencial de abuso y el estigma de tomar una medicación controlada, son razones para considerar otras alternativas a estos fármacos.
Mecanismo de acción y eficacia de los no estimulantes
La ATX inhibe muy selectivamente el transportador presináptico de NA, y así inhibe la recaptación de NA. Eleva los niveles de NA y DA en el córtex prefrontal, por lo que tiene un efecto beneficioso sobre el TDAH, pero no afecta a los niveles de NA y DA en el nucleus accumbens (zona del cerebro que media la respuesta a sustancias de abuso) ni en el estriado (zona implicada en el control de movimientos y en los tics). Se ha demostrado la eficacia de la ATX en niños a partir de 6 años, adolescentes y adultos con TDAH. La dosis eficaz es de 1,2-1,8 mg/kg/día. Se recomienda empezar con 0,5 mg/kg/día y, tras 1-2 semanas, según tolerabilidad, subir a 1,2 mg/kg/día. Se administra 1 vez al día, por la mañana, pero si se tolera mal, puede darse por la noche, o en dosis divididas, mañana y noche, aunque puede ser algo menos eficaz sólo por la noche. Las comidas ricas en grasas mejoran la tolerabilidad. Las ventajas de la ATX son su acción homogénea y suave sin altibajos y sin sensación de «subida» durante el día, la posibilidad de administrarse en una sola toma, su ausencia de potencial de abuso, de efecto negativo sobre el sueño y producción de tics, además de un efecto beneficioso en los pacientes con comorbilidad con trastorno negativista desafiante y su perfil de tolerabilidad y seguridad. Entre las desventajas, cabría citar que puede tardar hasta 12 semanas en llegar a su efecto beneficioso máximo, y el porcentaje de pacientes que responden es algo menor que el del MTF, 0,7-0,8.
La GXR de acción prolongada es un agonista selectivo de los receptores adrenérgicos postsinápticos alfa-2A, favoreciendo la transmisión de NA (aumenta la señal y mejora la ratio señal/ruido). En el cerebro se une selectivamente a esos receptores y así fomenta la función cognitiva, refuerza los impulsos sinápticos y favorece la conectividad de las redes celulares prefrontales. Está indicada entre los 6 y los 17 años de edad en niños con comorbilidad cuando los estimulantes no son adecuados, no se toleran o son ineficaces. El tamaño de su efecto es de 0,8. Se administra 1 vez al día, por la mañana o por la noche, y tiene una duración de efecto de 24 horas. La dosis habitual es de 1-4 mg/día y aumenta su efecto con la comida grasa. No se debe masticar o triturar la cápsula, ya que ello aumenta su velocidad de liberación. Se produce una mejora significativa de su efecto en la tercera semana.
Efectos adversos de los no estimulantes
La ATX generalmente se tolera bien. Los efectos secundarios suelen ser leves, se presentan al principio del tratamiento y suelen mejorar a los pocos días/semanas. Inicialmente se asocia a una pérdida de peso leve, dolor abdominal, insomnio, irritabilidad, náuseas, vómitos, somnolencia diurna, tos y fatiga. No empeora los tics. Se ha descrito 1 caso (entre más de 4 millones de pacientes tratados) de elevación de las enzimas hepáticas, que se normalizaron al retirar el tratamiento (hepatitis tóxica). Puede producir una ligera elevación de la presión arterial diastólica. No alarga el intervalo QTc del ECG, aun en las dosis más altas, por lo que no es necesario realizar ECG de forma sistemática. Está contraindicada y no debe administrarse conjuntamente con los inhibidores de la monoaminooxidasa (IMAO); si se ha usado un IMAO, deben esperarse 2 semanas antes de empezar a tomar ATX, y viceversa. Se ha detectado que el 0,44% de los niños tratados con ATX tenían ideas suicidas, aunque no se ha descrito ningún caso de suicidio y la frecuencia es inferior a lo esperable en la población general (del 11-30%); en cualquier caso, este síntoma debe tenerse en cuenta.
La GXR puede producir hipotensión, bradicardia, síncope, sedación y somnolencia, que suelen ceder en la tercera semana, y también cefalea, fatiga y dolor abdominal. Asimismo, puede provocar un aumento de peso. No se debe utilizar con depresores del SNC (alcohol, barbitúricos, sedantes, hipnóticos…), pues favorece la sedación y la somnolencia, ni tampoco con inhibidores del citocromo CYP3A4/5 (ketoconazol, eritromicina) o inductores del mismo (rifampicina, barbitúricos). Su retirada debe realizarse paulatinamente para minimizar los efectos adversos (hipertensión). Su uso estará supervisado por un especialista.
Otras medicaciones
Otros fármacos, como el bupropión y los antidepresivos tricíclicos, tienen un nivel de evidencia sobre su eficacia y seguridad mucho menor y no han conseguido aprobación para tratar el TDAH. Los antipsicóticos y los antidepresivos inhibidores selectivos de la recaptación de serotonina (ISRS) no son eficaces para los síntomas del TDAH.
En resumen, el tratamiento farmacológico es un pilar central del tratamiento del TDAH en la mayoría de los niños, excepto en casos leves. En el tratamiento farmacológico del TDAH la evidencia de eficacia apoya el uso, en primer lugar, de estimulantes (LDX o MTF, por este orden), y luego de no estimulantes (GXR o ATX, por este orden). La exigencia burocrática de visados para LDX y GXR conlleva que el orden de eficacia no sea el mismo que se usa en España, donde se exige fallo del tratamiento con MTF para poder probar LDX. Este requisito tenderá a desaparecer con el tiempo, como pasó con el visado de ATX, que fue obligatorio unos años nada más ser aprobada.
Generalmente, el tratamiento del TDAH se inicia con un estimulante; en España suele ser MTF, aunque la evidencia de eficacia apoyaría más la LDX, pero también puede que se tolere algo peor y su precio es más alto. Las formas de MTF de liberación prolongada, acción media y larga, aunque con un coste económico mayor, ofrecen ventajas sobre las formas de acción corta: mayor adherencia, efecto más suave, gradual y estable a lo largo del día, menor estigmatización y menor riesgo de uso inadecuado o abuso de la medicación. Los efectos adversos de las medicaciones generalmente son leves y transitorios, y aparecen al inicio y en los aumentos de dosis del tratamiento. Deben monitorizarse el peso, la talla, la presión arterial y la frecuencia cardiaca. Se debe evaluar periódicamente la necesidad de continuar el tratamiento tras un periodo largo de remisión completa de los síntomas. No debe suspenderse el tratamiento los fines de semana o en vacaciones, porque puede aumentar el riesgo de accidentes, impulsividad sexual (embarazos, enfermedades de transmisión sexual), irritabilidad, falta de eficacia y peor tolerabilidad al reiniciarlo. Aunque generalmente se usan primero los estimulantes (por su mayor tamaño de efecto y su inicio de acción más rápido), también pueden iniciarse primero los no estimulantes, según las características del paciente.
Los factores que influyen en la elección del fármaco son los siguientes: comorbilidad, potenciales efectos adversos (bajo apetito, insomnio, tics y potencial de abuso de la medicación), preferencia de los padres y del paciente, necesidad de acción a lo largo del día o en momentos concretos, necesidad de inicio rápido de acción, precio y necesidad de visado de la medicación.
Si con MTF (o LDX) no se obtiene una buena respuesta, el siguiente paso es cambiar de estimulante (usar LDX en los pacientes que no responden a MTF, y viceversa). En el caso de que la medicación estimulante se tolere mal, se puede cambiar a otro estimulante (LDX en los pacientes que no toleran MTF, y viceversa), o pasar a un no estimulante (ATX o GXR). La evidencia de eficacia es algo superior con GXR, y la tolerabilidad algo mejor con ATX.
El pediatra de atención primaria tiene un papel fundamental en la atención al niño y adolescente con TDAH. Debe conocer el trastorno para poder realizar una detección precoz e iniciar el tratamiento multimodal del TDAH sin comorbilidad y/o derivar al paciente al especialista (neuropediatra/psiquiatra de niños y adolescentes), según la comorbilidad presente o si el proceso no evoluciona bien (algoritmos 1 y 2). También actuará de coordinador del tratamiento con otros profesionales y realizará el seguimiento apoyando al paciente, la familia y la escuela.
Evolución y pronóstico
En un estudio longitudinal realizado en 2013, basado en el seguimiento de 5.718 niños, de los cuales 367 tenían diagnóstico de TDAH, se observaron los siguientes aspectos:
- Un 29% de los niños con TDAH mantenían este trastorno en la edad adulta. El 81% presentaba, al menos, un trastorno psiquiátrico.
- Entre los trastornos psiquiátricos encontrados en la edad adulta, destacaban el abuso y/o dependencia de sustancias, el trastorno de personalidad antisocial, los episodios hipomaniacos, la ansiedad generalizada y la depresión mayor.
- La mortalidad era mayor en el grupo de TDAH (el 1,9 frente al 0,74% en el grupo control), así como las tasas de fallecimiento por suicidio.
El pronóstico de estos pacientes es mejor cuando predomina la inatención, más que la hiperactividad-impulsividad, si no se desarrolla una conducta negativista o antisocial, en ausencia de psicopatología familiar, tras la instauración de un diagnóstico y un tratamiento precoces, y si las relaciones con los familiares y el entorno son adecuadas.
Bibliografía
Althoff RR. What child mental health professionals should know about genetics. En: Rey JM, ed. IACAPAP e-textbook of child and adolescent mental health. Ginebra: International Association for Child and Adolescent Psychiatry and Allied Professions, 2016. Disponible en: https://iacapap.org/content/uploads/A.13-GENETICS-2016.pdf
American Academy of Pediatrics. Subcomité sobre Trastorno por Déficit de Atención/Hiperactividad. Comité Directivo sobre Mejora de la Calidad y Tratamiento. TDAH: Guía de práctica clínica para el diagnóstico, evaluación y tratamiento del trastorno por déficit de atención e hiperactividad en niños y adolescentes. Pediatrics. 2011; 128: 1.007-1.022.
American Psychiatric Association. Attention-deficit/hyperactivity disorder. En: Diagnostic and statistical manual of mental disorders, fifth edition (DSM-5). Arlington: American Psychiatric Association, 2013; 59.
Barkley RA. Executive functions. What they are, how they work and how they evolved. Nueva York: Guilford Press, 2012.
Biederman J, Petty CR, Woodworth KY, Lomedico A, Hyder LL, Faraone SV. Adult outcome of ADHD: a controlled 16-year follow-up study. J Clin Psychiatry. 2012; 73(7): 941-950.
Castellanos FX, Lee PP, Sharp W, Jeffries NO, Greenstein DK, Clasen LS, et al. Developmental trajectories of brain volume abnormalities in children and adolescents with ADHD. JAMA. 2002; 288: 1.740-1.748.
Cortese S, Imperati D, Zhou J, Proal E, Klein RG, Mannuzza S, et al. White matter alterations at 33-year follow-up in adults with childhood ADHD. Biol Psychiatry. 2013; 74: 591-598.
Cortese S, Kelly C, Chabernaud C, Proal E, Di Martino A, Milham MP, et al. Toward systems neuroscience of ADHD: a meta-analysis of 55 fMRI studies. Am J Psychiatry. 2012; 169: 1.038-1.055.
Cubillo A, Rubia K. Structural and functional brain imaging in adult ADHD. Exp Rev Neurother. 2010; 10: 603-620.
Fernández Pérez M, Hidalgo Vicario MI, Lora Espinosa A, Sánchez Santos L, Rodríguez Molinero L, Eddy Ives LS, et al. La atención primaria y el trastorno por déficit de atención con/sin hiperactividad (TDAH): consenso multidisciplinar y evidencias para la puesta en práctica. Madrid: Acindes, 2009; 1-24.
Fernández-Jaén A, Martín Fernández-Mayoralas D, Calleja-Pérez B, Muñoz-Jareño N, López-Arribas S. Endofenotipos genómicos del TDAH. Rev Neurol. 2012; 54 Supl 1: 81-87.
Grupo de trabajo de la Guía de Práctica Clínica sobre el Trastorno por Déficit de Atención con Hiperactividad (TDAH) en Niños y Adolescentes. Fundación Sant Joan de Déu, coordinador. Guía de práctica clínica sobre el trastorno por déficit de atención con hiperactividad (TDAH) en niños y adolescentes. Plan de Calidad para el Sistema Nacional de Salud (SNS) del Ministerio de Sanidad, Política Social e Igualdad. Agencia d’Informacio, Avaluació i Qualitat (AIAQS) de Catalunya, 2010. Guías de Práctica Clínica en el SNS: AATRM n.º 2007/18.
Hidalgo Vicario MI, Alda Díez JA. Guía de práctica clínica del trastorno por déficit de atención e hiperactividad y algoritmos de actuación. En: Rodríguez Hernández PJ, coord. TDAH en pediatría. Madrid: Science Communications, 2013; 113-117.
Hidalgo Vicario MI, Soutullo Esperón C. Trastorno por déficit de atención e hiperactividad. En: Muñoz Calvo MT, Hidalgo Vicario MI, Clemente Pollán J, eds. Pediatría extrahospitalaria. Fundamentos clínicos en atención primaria. Madrid: Ergon, 2008; 678-690.
Hoogman M, Bralten J, Hibar DP, Mennes M, Zwiers MP, Schweren LS, et al. Subcortical brain volume differences in participants with attention deficit hyperactivity disorder in children and adults: a cross-sectional mega-analysis. Lancet Psychiatry. 2017; 4(4): 310-319.
Nakao T, Radua J, Rubia K, Mataix-Cols D. Gray matter volume abnormalities in ADHD: voxel-based meta-analysis exploring the effects of age and stimulant medication. Am J Psychiatry. 2011; 168: 1.154-1.163.
Número monográfico sobre trastorno por déficit de atención e hiperactividad. Pediatr Integral. 2014; 9: 595-692.
Pereira V, De Castro-Manglano P, Soutullo C. Brain development in ADHD: a neuroimaging perspective. En: López-Muñoz F, Álamo C, eds. Attention deficit hyperactivity disorder (ADHD): epidemiology, treatment and prevention. Nueva York: Nova Science Publishers, Inc., 2015; 257-272.
Polanczyk G, Willcutt EG, Salum GA, Kieling C, Rohde LA. ADHD prevalence estimates across three decades: an updated systematic review and meta-regression analysis. Int J Epidemiol. 2014; 1-9.
San Sebastián Cabasés J, Soutullo Esperón C, Figueroa Quintana A. Trastorno por déficit de atención e hiperactividad (TDAH). En: Soutullo C, Mardomingo MJ, eds. Manual de psiquiatría del niño y del adolescente (AEPNYA). Madrid: Editorial Médica Panamericana, 2010; 57-78.
Sánchez-Mora C, Ribasés M, Mulas F, Soutullo C, Sans A, Pàmias M, et al. Bases genéticas del TDAH. Rev Neurol. 2012; 55(10): 609-618.
Schulz KP, Bédard AV, Fan J, Hildebrandt TB, Stein MA, Ivanov I, et al. Striatal activation predicts differential therapeutic responses to methylphenidate and atomoxetine. J Am Acad Child Adolesc Psychiatry. 2017; 56(7): 602-609.e2 [DOI: 10.1016/j.jaac.2017.04.005] [Epub 2017 May 10].
Soutullo C, Díez-Suárez A. Manual de diagnóstico y tratamiento del TDAH. Madrid: Ed. Panamericana, 2007.
Soutullo C, San Sebastián Cabasés J, Miranda Vicario EM, Figueroa Quintana A. Psicofarmacología del TDAH: estimulantes. En: Soutullo C, et al., eds. Guía básica de psicofarmacología del TDAH. Madrid: Springer SBM Spain SAU, 2012.
Sonuga-Barke EJ, Halperin JM. Developmental phenotypes and causal pathways in ADHD: potential targets for early intervention? J Child Psychol Psychiatry Allied Discipl. 2010; 51: 368-389.
Thapar A, Martin J, Mick E, Arias Vásquez A, Langley K, Scherer SW, et al. Psychiatric gene discoveries shape evidence on ADHD’s biology. Mol Psychiatry. 2015 [pii: 1087054715613440] [Epub ahead of print] PMID: 26610740.
Zayats T, Athanasiu L, Sonderby I, Djurovic S, Westlye LT, Tamnes CK, et al. Genome-wide analysis of ADHD in Norway. PLoS One. 2015; 10(4): e0122501 [DOI: 10.1371/journal.pone.0122501. eCollection 2015].